GLP-1被查,“风波”加剧?
12月1日,欧洲药品监督管理局(EMA)风险评估委员会表示,需要进一步了解可能与GLP-1受体激动剂有关的自杀和自残念头的潜在风险,要求GLP-1药物生产商对相关药物多个方面的问题作出澄清。
据EMA称,其药物警戒风险评估委员会(PRAC)目前已评估了所有来自临床试验、上市后监测和已发表文献的所有可用证据,这些证据涉及GLP-1受体激动剂有关的自杀念头和自残念头的报告病例。EMA表示,目前暂不能作出自杀意念和GLP-1之间具有因果关系的结论。
其实,对GLP-1受体激动剂的审查最早于今年7月展开,最初的审查重点是诺和诺德的相关产品,包括司美格鲁肽和利拉鲁肽等,随后扩大到包括所有上市的GLP-1受体激动剂。
阿斯利康、礼来和赛诺菲
也在审查名单之中
今年7月初,冰岛药品管理局报告了3例用药者有自杀自残想法案例,两起涉及Saxenda以及一起涉及Ozempic。对此,EMA对150份有相关自杀自残的案例展开了调查,包括司美格鲁肽(Ozempic、Rybelsus和Wegovy)和同属GLP-1类减肥药的利拉鲁肽(Saxenda、Victoza和Xgovy)用药者,评估药物与自杀意愿的相关性。
与此同时,据报道,自2010年以来,美国FDA已收到265份有关服用GLP-1受体激动剂的患者出现自杀念头或行为的报告,其中包括36例自杀或疑似自杀死亡病例报告,目前FDA正在评估这些报告,以决定是否需要采取相关行动。
减肥药致自杀并非骇人听闻。2008年赛诺菲推出的Acomplia就因自杀风险被欧洲撤出市场,也未在美国获批。
诺和诺德发言人对外表示,患者安全是诺和诺德的首要任务,将继续配合监管机构调查,对相关问题作出澄清。
随着审查的展开,GLP-1药物审查名单已经扩大到其他已上市的GLP-1受体激动剂。据EMA最新发布的公告消息,除首当其冲的诺和诺德外,阿斯利康、礼来和赛诺菲也将面临PRAC的调查。
值得注意的是,自杀自残并不是落在GLP-1药物头上的第一朵“疑云”,在此之前,GLP-1就已陷入另一场风波。
自杀自残之前
还有“致癌疑云”
今年5月,据外媒报道,GLP-1类药物出现甲状腺癌的安全性信号,随后EMA要求礼来、诺和诺德、阿斯利康、赛诺菲等研发GLP-1类药物的企业在7月26日之前提供GLP-1类药物补充信息。
EMA对GLP-1药物致癌风险的担忧源于2023年1月欧洲药品管理局安全委员会的一次会议,该会议引用了2022年的一项研究,研究结果表明在2型糖尿病患者中使用这些药物可能会增加患甲状腺癌的风险。
自4月以来,EMA一直在密切监测GLP-1药物的使用情况,严格审查所有可用数据,包括非临床、临床和上市后信息,以评估甲状腺癌风险的任何潜在增加。
此次PRAC的全面审查就涵盖诺和诺德的司美格鲁肽和利拉鲁肽、礼来的度拉糖肽和阿斯利康的艾塞那肽等。
EMA和FDA均对Wegovy给予了黑框警告,警示患者注意甲状腺肿瘤的风险,在服用Wegovy和类似药物的啮齿类动物身上发现了甲状腺肿瘤。然而,尚不清楚该药物是否会导致人体出现肿瘤或甲状腺髓样癌。诺和诺德方则表示,Wegovy与甲状腺癌症之间的因果关系尚不成立。
自7月以来,在司美格鲁肽等一众GLP-1药物头上飘了许久的致癌阴云一直挥之不去。但好在经过数月审查,最后疑云消散。
EMA于10月27日宣布,PRAC没有发现任何确凿证据表明诺和诺德的司美格鲁肽和其他GLP-1药物与甲状腺癌存在因果关系。

图片来源:EMA官网
无独有偶,就在EMA宣布加大对GLP-1药物调查力度的前几日,CAR-T疗法也收到了来自FDA的一张“传票”。
CAR-T也难逃致癌风波
11月28日,美国FDA发布公告称,正在调查接受CAR-T治疗的患者是否出现T细胞淋巴瘤(包括携带工程化T细胞的癌细胞)。
FDA表示,“虽然CAR-T药物获批用途的整体获益继续超出其潜在风险,但FDA正在调查已确定的T细胞恶性肿瘤风险及所导致的严重后果,包括住院和死亡,并正在评估采取监管行动的必要性。”
调查事件的起因,是FDA收到的来自临床试验和上市后不良事件(AE)数据源中,接受BCMA、CD19靶向自体CAR-T疗法治疗的患者出现T细胞恶性肿瘤的报告,其中部分严重患者已经住院或死亡。
根据FDAFAERSdatabase目前的披露,此次FDA调查的产品名单包括6款产品:百时美施贵宝研发的分别用于治疗多发性骨髓瘤和大B细胞淋巴瘤的Abecma和Breyanzi、诺华研发的用于治疗成人和儿童淋巴瘤Kymariah、吉利德旗下用于治疗白血病和淋巴瘤的Yescarta和Tecartus和强生/传奇生物联合研发用于治疗多发性骨髓瘤的Carvykti。
6款产品共报告了12例T细胞淋巴瘤病例。
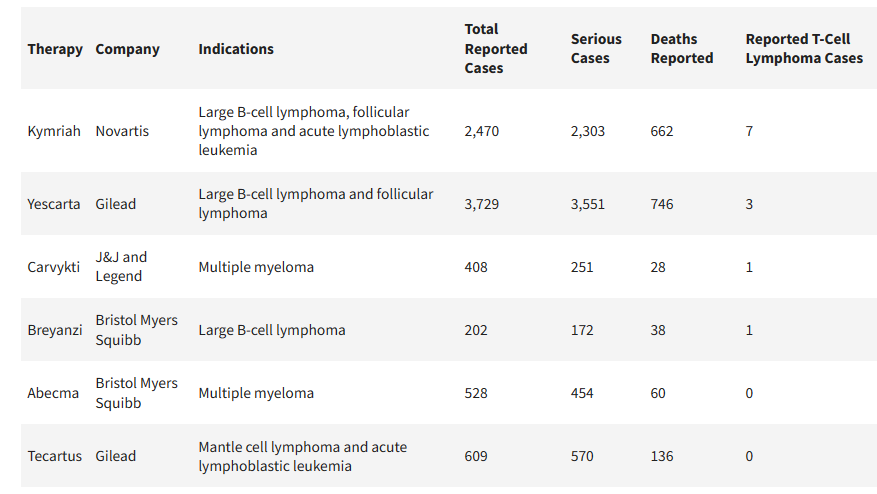
图片来源:FIERCEPharma
值得注意的是,所有含有整合载体(慢病毒或逆转录病毒载体)的基因疗法产品,包括CAR-T疗法,都被美国处方信息(USPIs)标记为发展二次恶性肿瘤的潜在风险。
受此消息影响,多家CAR-T疗法相关公司股价波动。开发自体CAR-T疗法的AutolusTherapeutics以4.78美元开盘后,跌至3.05美元,收盘回升至4.55美元;CAR-NK疗法开发公司Nkarta全天波动,但仅下跌了约1%;吉利德旗下Arcellx以52.95美元开盘,跌至48.37美元,后回升至51.1美元收盘。
而涉及到的拥有靶向BCMA或CD19自体CAR-T疗法的公司,如与强生合作开发Carvykti的传奇生物以61.69美元开盘后最低跌至57.38美元的低点,BMS也从49.99美元跌至48.92美元,吉利德从74.92美元小幅跌至74.51美元。
CAR-T疗法致癌被查消息爆出对药企的影响除了体现在股价波动上之外,还有内部人员管理方面。
吉利德旗下CAR-T细胞疗法龙头企业KitePharma,在FDA审查消息放出次日便作出了裁员通知,宣布将裁员400人。
KitePharma手握最早获批上市的CAR-T疗法Yescarta和Tecartus,这两款细胞药物2023年第三季度销售额总计近5亿美元,均在此次FDA调查的产品名单之中。
结语
CAR-T细胞疗法和GLP-1受体激动剂都是当下热门的治疗疗法和药物,但相继卷入安全性监管风暴之中,为药企创新技术打了一剂镇定剂。用药安全无小事,致癌不等同于副作用,任何对患者产生不良反应的事件都不能忽视。在这个过程中,监管机构就承担着不可或缺的作用。让监管跑在风险前,才是对用药安全性最好的回应。
参考资料:
1.https://endpts.com/ema-sends-more-questions-to-glp-1-makers-over-possible-risk-of-suicide-self-harm/
2.CAR-T再起重大风波;https://mp.weixin.qq.com/s/jWdlYPKG1LLVOUZ4pBptFg
声明:本文系神州医药网转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与我们联系,我们将在第一时间删除内容!
推荐资讯
神州医药热门单品推荐

- 2024第五届西藏医疗器械及大健康产业展览会
- 主要产品:
- 热度:

- 了解详情

- 2024香港国际生物科技展览暨论坛
- 主要产品:
- 热度:

- 了解详情

- 2024第32届广州国际大健康产业博览会
- 主要产品:
- 热度:

- 了解详情

- 2026第35届【北京】中国国际健康产业博览会
- 主要产品:
- 热度:

- 了解详情

- 2026第20届上海国际养老与辅具及康复医疗博览会(AID老博会)
- 主要产品:
- 热度:

- 了解详情
- 医药资讯
- 涨超120%的皮炎明星药,17家药企竞逐国产第3家
- 获批!国产改良型新药,登陆美国
- 又一1类新药获批上市!销售收入有望超60亿
- 彭水俊苗山医药研究院
- 今年1—7月,职工医保个账家庭共济金额达227亿元
- 关于做好2024年城乡居民基本医疗保障有关工作的通知
- 中药面包、中药冰淇淋…是养生还是智商税?专家提醒
- 十八次方干膜上市
- 国家卫健委:全面推进紧密型县域医共体建设
- 国家药监局综合司关于印发药品监管人工智能典型应用场景清单的通知

网站备案号:琼ICP备2022001664号-24 增值电信业务经营许可证:琼B2-20221748
神州医药网郑重提示:本网站只起到信息平台作用,不对交易行为负担任何责任,请自行核实,谨慎行事。
任何单位及个人不得发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息。
联系电话:400-101-5699 手机:18815323799(同微信)(只提供招商信息服务,不卖药) 客服微信/QQ:3331677131 邮箱:shenzhouyibo@126.com
 琼公网安备46010002000141号
琼公网安备46010002000141号
























点击留言(留言后专人第一时间快速对接)
已有 1826 企业通过我们找到了合作项目