刚刚!诺华重磅罕见病创新药拟纳入优先审评
今日(6月5日),中国国家药监局药品审评中心(CDE)官网显示,北京诺华制药有限公司申请的盐酸伊普可泮胶囊拟纳入优先审评,用于成人阵发性睡眠性血红蛋白尿症(PNH)患者的治疗。

图片来源:CDE官网
盐酸伊普可泮胶囊(iptacopan)的项目代号为LNP-023,一种一流的、口服给药的、强效的、高选择性的补体替代途径的B因子抑制剂。目前已在全球多地开展了临床试验,适应症涵盖C3肾小球病、阵发性夜间血红蛋白尿和非典型溶血尿毒综合征等。
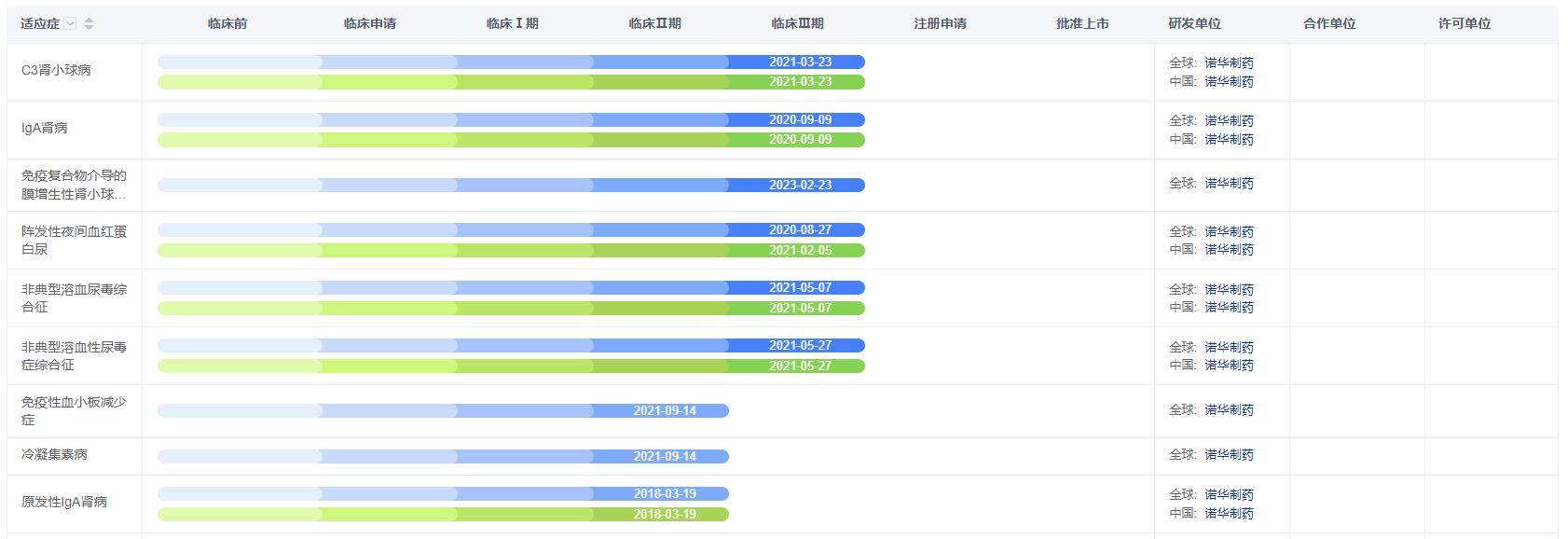
图片来源:药智数据——全球药物分析系统
LNP-023还曾被CDE纳入突破性治疗品种名单,适应症分别为阵发性睡眠性血红蛋白尿(PNH)和C3肾小球病(C3G)。此前,LNP-023获得了FDA和EMA突破性疗法认定,用于治疗PNH和C3G;并且还获得FDA罕见儿科疾病认定,用于治疗C3G。
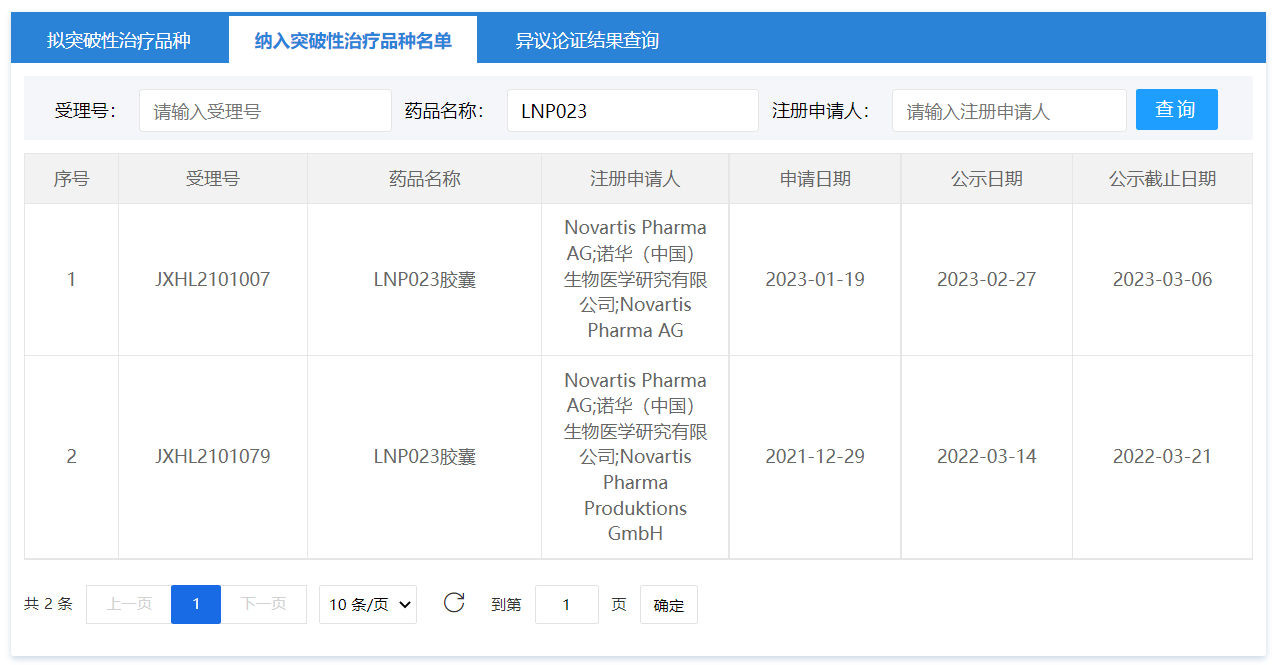
图片来源:CDE官网
C3肾小球肾炎是近几年来比较罕见的肾小球疾病,其发病机理与补体的旁路系统的调控失调有关系。阵发性睡眠性血红蛋白尿症是一种由于1个或几个造血干细胞经获得性体细胞PIG-A基因突变造成的非恶性的克隆性疾病,临床上主要表现为慢性血管内溶血,造血功能衰竭和反复血栓形成,已被收录入《第一批罕见病目录》中。
CDE官网显示,盐酸伊普可泮胶囊拟纳入优先审评,依据范围为:“(一)临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药”以及“(四)纳入突破性治疗药物程序的药品”。
诺华还曾表示,iptacopan(LNP023)最快预计今年下半年上市。作为一款罕见病药物,LNP023上市后市场表现如何,可以拭目以待。
声明:本文系神州医药网转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!
推荐资讯
神州医药热门单品推荐

- 2024第五届西藏医疗器械及大健康产业展览会
- 主要产品:
- 热度:

- 了解详情

- 2024香港国际生物科技展览暨论坛
- 主要产品:
- 热度:

- 了解详情

- 2024第32届广州国际大健康产业博览会
- 主要产品:
- 热度:

- 了解详情

- 2026第35届【北京】中国国际健康产业博览会
- 主要产品:
- 热度:

- 了解详情

- 2026第20届上海国际养老与辅具及康复医疗博览会(AID老博会)
- 主要产品:
- 热度:

- 了解详情
- 医药资讯
- 涨超120%的皮炎明星药,17家药企竞逐国产第3家
- 获批!国产改良型新药,登陆美国
- 又一1类新药获批上市!销售收入有望超60亿
- 彭水俊苗山医药研究院
- 今年1—7月,职工医保个账家庭共济金额达227亿元
- 关于做好2024年城乡居民基本医疗保障有关工作的通知
- 中药面包、中药冰淇淋…是养生还是智商税?专家提醒
- 十八次方干膜上市
- 国家卫健委:全面推进紧密型县域医共体建设
- 国家药监局综合司关于印发药品监管人工智能典型应用场景清单的通知

网站备案号:琼ICP备2022001664号-24 增值电信业务经营许可证:琼B2-20221748
神州医药网郑重提示:本网站只起到信息平台作用,不对交易行为负担任何责任,请自行核实,谨慎行事。
任何单位及个人不得发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息。
联系电话:400-101-5699 手机:18815323799(同微信)(只提供招商信息服务,不卖药) 客服微信/QQ:3331677131 邮箱:shenzhouyibo@126.com
 琼公网安备46010002000141号
琼公网安备46010002000141号
























点击留言(留言后专人第一时间快速对接)
已有 1826 企业通过我们找到了合作项目