长生生物疫苗案余震,20名官员被问责;25家药企半年报出炉,沃森生物净利润猛增270.08%
上周,长生疫苗案余震,7位药监局,13名吉林省、长春市相关官员被问责;又一省发文,通过一致性评价的生产企业达到3家以上的,未通过的暂停挂网;25家药品研发、生产企业发布2018年半年度报告,沃森生物、药明生物、赛托生物、普利制药4药企净利润增速都超过了100%,沃森生物更是达到了270.08%,近3倍的增长,天坛生物、未名医药出现净利润大幅下跌;爆点不断,我们一起来看看:
药监局余震,5位官员予以免职,1位接受审查、调查
8月18日,市场监管总局发布了《国家市场监督管理总局对问题疫苗案件相关工作人员问责》,对原国家食药监总局(国家药监局)药品化妆品监管司司长、食药审核查验中心主任丁建华予以免职,副司长董润生、孙京林予以免职,特殊药品监管处处长、处调研员叶国庆、郭秀侠予以免职;责成中国食品药品检定研究院院长(主任)李波做出深刻检查。
8月23日,药监局发布,原国家食药监总局药品化妆品注册管理司(中药民族药监管司)司长王立丰涉嫌严重违纪违法,目前正接受纪律审查和监察调查。
吉林省、长春市接连出手,13名官员被问责
8月22日,吉林省政府下发通知,决定免去吉林省食药监局(省食品药品安全委员会办公室)局长(主任)郭洪志的职务,同时免去曾向东、闫海江的省食药监局(省食品药品安全委员会办公室)副局长(副主任)职务。
早在8月16日,吉林省委常委会议就研究决定,对相关5名干部作出组织处理,除以上提及的3人,还有吉林省工信厅党组书记、厅长白绪贵也被免职,长春市副市长、市公安局局长吕锋1人做深刻检查。同日,长春市委常委会议研究决定,对长春市相关8名人员作出组织处理。
一致性评价进展
5个品种获受理,1个首次申报,1品种已发件
截止8月24日,CDE共注册受理一致性评价受理号314个,其中已通过受理号有64个,涉及33家企业的34个品种。本周(8月17-24日)新增5个受理号,涉及5家公司的5个品种(具体详情如下图)。其中,卡托普利片已有常州制药厂、石药欧意两家获批通过,齐鲁制药(海南)的酒石酸长春瑞滨注射液为首家申报。
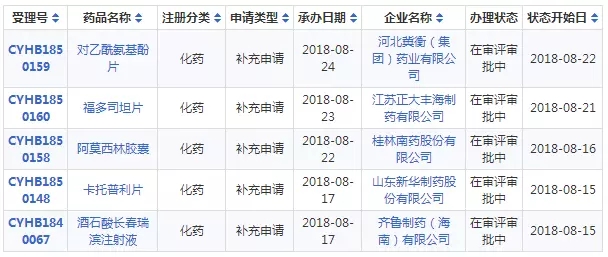
另外,本周江苏恒瑞的盐酸伊立替康注射液办理状态更新为已发件,目前该品种暂无通过企业;恩华药业的氯硝西泮片办理状态更新为审批完毕-待制证,该品种除恩华药业外,还未有企业申报。
这5个一致性评价品种,已集满3家!
8月22日,联邦制药公告,公司全资附属中山分公司生产的头孢呋辛酯片(0.25g),已于2018年8月6日获批通过仿制药质量和疗效一致性评价,为国内第3家获批该产品一致性评价的生产企业。据药智药品注册与受理数据库显示,其它2家为国药集团致君(深圳)、成都倍特药业。
另外,已有4个品种通过一致性评价的企业已达3家。具体药品和通过企业有:富马酸替诺福韦二吡呋酯片,0.3g(正大天晴、齐鲁制药、成都倍特药业);瑞舒伐他汀钙片,10mg(正大天晴、京新药业、海正药业);蒙脱石散,3g(先声药业、扬子江药业、四川维奥制药);苯磺酸氨氯地平片,5mg(江苏黄河药业、华润赛科药业、扬子江药业上海海尼药业)。
又一省发文!未过一致性评价暂停挂网
8月22日,浙江省卫计委发布关于浙江省医改办公开征求《关于改革完善仿制药供应保障及使用政策的实施意见》提出,通过一致性评价仿制药与原研药同等对待、采购价格不得高于原研药、医保支付标准不高于外省挂网价和支付价等。同时明确,同品种药品,通过一致性评价的生产企业达到3家以上的,未通过一致性评价的在线交易产品原则上暂停交易资格。
除了上周的江西发文明确,同品种药品,通过一致性评价的生产企业达到3家以上的,未通过一致性评价的在线交易产品原则上暂停交易资格,广西、福建、天津、河北、吉林、辽宁、陕西、甘肃等多省市,也已发文对上述要求进行明确规定。
企业半年度报告看点
本周,25家药品研发、生产企业发布2018年半年度报告,具体数据如下图:

25家药企2018年半年度报告(按营业收入排序)
从整体来看,25家企业的3项指标营业收入、净利润和研发投入,绝大部分药企都保持上升,发展趋势看好。
营收方面,云南白药、中国生物制药、华润三九位列前三名,分别收入129.74亿元、97.25亿元、64.72亿元,其中中国生物制药的研发投入高达13.28亿元,是其它企业所不能及的;从营收增长速度来看,普利制药、赛托生物、药明生物3家企业增长速度超过了50%。
从净利润看,沃森生物、药明生物、赛托生物、普利制药四药企增速都超过了100%,沃森生物更是达到了270.08%,近3倍的增长,而且沃森生物研发投入为1.56亿元,接近营业收入3.75亿元的一半。
在3项指标出现下跌的企业中,天坛生物净利润跌幅-72.73%,研发投入下跌-31.93%;未名医药营收下跌-44.60%、净利润下跌-96.84%、研发投入下跌-0.16%;盘龙药业虽然净利润涨了71.07%,但研发投入却跌了-25.19%。
其他行业热点
国家局对打破原料药垄断的答复
8月21日,针对熊维政在今年两会上提交的《关于进一步加强监管,降低原料药准入条件的建议》,国家药监局作出回复,药品监管部门不承担对原料药垄断的查处职责,但会积极配合原料药垄断查处中涉及的提供药品批准信息等相关工作。同时,持续完善原料药管理措施。将原料药申请由单独审批改为在审批药品制剂注册申请时一并审评审批,采取登记备案管理,在不降低审评审批标准的同时优化工作流程、提高工作效率。
药典委拟修订缬沙坦药典标准
近日,国家药典委员会发布《关于缬沙坦国家标准修订稿的公示》称,拟修订缬沙坦药典标准。
国家药典委员会拟在缬沙坦药典标准中增订生产要求:必须对生产工艺进行评估以确定形成N-亚硝基二甲胺的可能性。必要时,需对生产工艺进行验证以说明在成品中N-亚硝基二甲胺的含量符合规定。N-亚硝基二甲胺采用照气相色谱法(通则0521)和质谱法(通则0431)测定,限度不得过千万分之三。
亚盛医药宣布赴港上市
8月20日,亚盛医药宣布已经在港交所递交上市申请。在招股文件中,公司尚未披露具体的募资金额。亚盛医药于2015年获9600万元人民币A轮融资;随后在2016年底获5亿元人民币的B轮融资;2018年又获10亿元人民币C轮融资,预计投后总估值达40亿元。目前,该公司有7款新药处于临床试验阶段,有20项正在进行的临床试验。其中,APG-1252、APG-2575、以及HQP1351是其研发管线中的核心产品。
信息来源:国家药监局、巨潮网、赛柏蓝、新华网等
声明:本文系神州医药网转载内容,版权归原作者所有,转载目的在于传递更多信息,并不代表本平台观点。如涉及作品内容、版权和其它问题,请与本网站留言联系,我们将在第一时间删除内容!
推荐资讯
神州医药热门单品推荐

- 2024第五届西藏医疗器械及大健康产业展览会
- 主要产品:
- 热度:

- 了解详情

- 2024香港国际生物科技展览暨论坛
- 主要产品:
- 热度:

- 了解详情

- 2024第32届广州国际大健康产业博览会
- 主要产品:
- 热度:

- 了解详情

- 2026第35届【北京】中国国际健康产业博览会
- 主要产品:
- 热度:

- 了解详情

- 2026第20届上海国际养老与辅具及康复医疗博览会(AID老博会)
- 主要产品:
- 热度:

- 了解详情
- 医药资讯
- 涨超120%的皮炎明星药,17家药企竞逐国产第3家
- 获批!国产改良型新药,登陆美国
- 又一1类新药获批上市!销售收入有望超60亿
- 彭水俊苗山医药研究院
- 今年1—7月,职工医保个账家庭共济金额达227亿元
- 关于做好2024年城乡居民基本医疗保障有关工作的通知
- 中药面包、中药冰淇淋…是养生还是智商税?专家提醒
- 十八次方干膜上市
- 国家卫健委:全面推进紧密型县域医共体建设
- 国家药监局综合司关于印发药品监管人工智能典型应用场景清单的通知

网站备案号:琼ICP备2022001664号-24 增值电信业务经营许可证:琼B2-20221748
神州医药网郑重提示:本网站只起到信息平台作用,不对交易行为负担任何责任,请自行核实,谨慎行事。
任何单位及个人不得发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息。
联系电话:400-101-5699 手机:18815323799(同微信)(只提供招商信息服务,不卖药) 客服微信/QQ:3331677131 邮箱:shenzhouyibo@126.com
 琼公网安备46010002000141号
琼公网安备46010002000141号
























点击留言(留言后专人第一时间快速对接)
已有 1826 企业通过我们找到了合作项目